Уголь — это один из самых древних видов топлива, известных человеку. И даже сегодня он занимает лидирующие позиции по объему использования. Причиной тому служит его распространенность, легкость добычи, переработки и использования. Но что он собой представляет? Какова химическая формула угля?
На самом деле данный вопрос не совсем корректен. Уголь — это не вещество, это смесь различных веществ. Их целое множество, поэтому полностью определить состав угля невозможно. Поэтому под химической формулой угля в этой статье мы будем подразумевать скорее его элементный состав и некоторые другие особенности.
Вам будет интересно:Логопедический кабинет: оформление своими руками
Но что мы можем узнать о состоянии этого вещества? Уголь образуется из останков растений в течение многих лет вследствие воздействия большой температуры и давления. А так как растения имеют органическую природу, то и в составе угля будут преобладать органические вещества.
В зависимости от возраста и иных условий происхождения угля его делят на несколько видов. Каждый вид отличается элементарным составом, наличием примесей и другими немаловажными характеристиками.
Бурый уголь
Является самым молодым видом угля. В нем даже наблюдается растительная древесная структура. Образуется напрямую из торфа на глубине порядка 1 километра.
Этот вид угля содержит достаточно большое количество влаги: от 20 до 40%. При попадании на воздух она испаряется, а уголь рассыпается в порошок. Далее речь пойдет о химическом составе именно этого сухого остатка. Количество неорганических примесей в буром угле также велико и составляет 20-45%. В качестве этих примесей выступают диоксид кремния, оксиды алюминия, кальция и железа. Также в нем могут содержаться оксиды щелочных металлов.
Много в этом угле и летучих органических и неорганических веществ. Они могут составлять до половины массы этого вида угля. Элементарный состав за вычетом неорганических и летучих веществ следующий:
- Углерод 50-75%.
- Кислород 26-37%.
- Водород 3-5%.
- Азот 0-2%.
- Сера 0,5-3%.
Каменный уголь

По времени образования этот вид угля идет следующим после бурого. Он имеет черный или серо-черный цвет, а также смоляной, иногда металлический блеск.
Влажность каменного угля значительно меньше бурого: всего 1-12%. Содержание летучих веществ в каменном угле очень колеблется в зависимости от места добычи. Оно может быть минимальным (от 2%), но может и достигать значений, аналогичных бурому углю (до 48%). Элементарный состав следующий:
- Углерод 75-92%.
- Водород 2,5-5,7%.
- Кислород 1,5-15%.
- Азот до 2,7%.
- Сера 0-4%.
Отсюда можно сделать вывод, что химическая формула угля каменного состоит из большего числа углерода, чем у бурого. Это делает данный вид угля более качественным топливом.
Открытый метод добычи
Основное преимущество добычи угля открытым способом — это относительная безопасность. Все дело в том, что он используется только в том случае, если глубина залегания породы не более 100 метров. Другими словами, не создается шахта, которая может обрушиться во время аварии. Сам процесс добычи осуществляется по следующей процедуре.
Для начала необходимо снять верхний слой почвы, которым укрыта порода. Данный слой называется вскрыша, а метод его удаления — вскрышеванием. Данная процедура, в зависимости от типа почвы, проводится при помощи бульдозеров, драглайнов, роторными экскаваторами или скриперами. После того как слой грунта будет убран, можно переходить к дроблению самой породы. Для этого используются дробилки, водяные пушки, бульдозеры и другую технику. Если порода в месторождении угля слишком плотная, то в редких случаях используется буровзрывная отбойка угля. Данный метод добычи обычно охватывает достаточно большую площадь.
Что касается недостатков метода, то они следующие:
- Во-первых, нанесение ощутимого вреда окружающей среде в месте добычи.
- Во-вторых, вся порода, которая добывается таким способом, содержит большое количество вредных примесей в своем составе.
Основные преимущества добычи угля открытым способом, помимо безопасности, — это высокая скорость, а также экономичность.

Антрацит

Антрацит — это самая древняя форма ископаемого угля. Ему присущ темно-черный цвет, и он имеет характерный металлический блеск. Это самый лучший уголь по количеству тепла, которое он выделяет при горении.
Количество влаги и летучих веществ в нем очень мало. Около 5-7% на каждый показатель. А элементарный состав характеризуется крайне высоким содержанием углерода:
- Углерод более 90%.
- Водород 1-3%.
- Кислород 1-1,5%.
- Азот 1-1,5%.
- Сера до 0,8%.
Больше угля содержится лишь в графите, который является дальнейшей стадией углефикации антрацита.
Древесный уголь

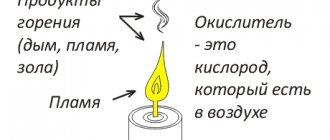
Этот тип угля не является ископаемым, поэтому он имеет некоторые особенности своего состава. Производят его путем нагрева сухой древесины до температуры 450-500 oC без доступа воздуха. Этот процесс называют пиролизом. В ходе него из древесины выделяется ряд веществ: метанол, ацетон, уксусная кислота и другие, после чего она превращается в уголь. Кстати, горение древесины — это тоже пиролиз, но из-за наличия кислорода воздуха загораются выделяющиеся газы. Именно этим и обуславливается наличие языков пламени при горении.
Древесина не является однородной, в ней очень много пор и капилляров. Подобная структура отчасти сохраняется и полученном из нее угле. По этой причине он обладает хорошей адсорбционной способностью и применяется наряду с активированным углем.
Влажность этого типа угля совсем небольшая (около 3%), но при длительном хранении он поглощает влагу из воздуха и процентное содержание воды повышается до 7-15%. Содержание неорганических примесей и летучих веществ регламентируется ГОСТами и должно составлять не более 3% и 20% соответственно. Элементный состав зависит от технологии получения, и примерно выглядит так:
- Углерод 80-92%.
- Кислород 5-15%.
- Водород 4-5%.
- Азот ~0%.
- Сера ~0%.
Химическая формула угля древесного показывает, что по содержанию углерода он близок к каменному, но вдобавок имеет лишь незначительное количество ненужных для горения элементов (серы и азота).
Максимальная температура горения угля (видео)
На сегодняшний день, такое применение разнообразного твердого топлива, в виде древесины, угля или торфа, является популярным. Его используют не только в быту для обогрева или приготовления пищи, но во многих отраслях промышленности.
Комментарии
0 Даниил 16.02.2018 13:06 Никогда об температуре горения не задумывался, но на практике антрацит показал себя лучше всего. Горит дольше и очень мало после него жужалки, в отличии от обычного угля. В результате антрацит и экономнее, отлично горит и мало после него отходов.
Цитировать
Обновить список комментариев RSS лента комментариев этой записи
Активированный уголь
Активированный уголь — это тип угля с высокой удельной поверхностью пор, из-за чего он обладает даже большей адсорбционной способностью, чем древесный. В качестве сырья для его получения используются древесный и каменный угли, а также скорлупа кокосовых орехов. Исходный материал подвергают процессу активации. Суть его состоит в том, чтобы вскрыть закупоренные поры действием высокой температуры, растворами электролитов или водяным паром.
В ходе процесса активации меняется лишь структура вещества, поэтому химическая формула активированного угля идентична составу сырья, из которого тот был изготовлен. Влажность активированного угля зависит от удельной поверхности пор и обычно составляет менее 12%.
Источник
Углерод
Углерод
Углерод — неметаллический элемент IV группы периодической таблицы Д.И. Менделеева, является важнейшей частью всех органических веществ в природе.

Общая характеристика элементов IVa группы
От C к Pb (сверху вниз в периодической таблице) происходит увеличение: атомного радиуса, металлических, основных, восстановительных свойств. Уменьшается электроотрицательность, энергия ионизация, сродство к электрону.
Из элементов IVа группы углерод и кремний относятся к неметаллам, германий, олово и свинец — металлы.

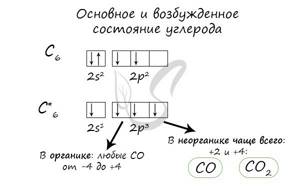
Электронные конфигурации у данных элементов схожи, так как они находятся в одной группе (главной подгруппе!), общая формула ns2np2:
- C — 2s22p2
- Si — 3s23p2
- Ge — 4s24p2
- Sn — 5s25p2
- Pb — 6s26p2
Природные соединения
В природе углерод встречается в виде следующих соединений:
- Аллотропных модификаций — графит, алмаз, фуллерен
- MgCO3 — магнезит
- CaCO3 — кальцит (мел, мрамор)
- CaCO3*MgCO3 — доломит

Получение
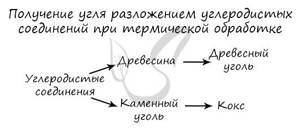
Углерод получают в ходе пиролиза углеводородов (пиролиз — нагревание без доступа кислорода). Также применяется получение углеродистых соединений: древесины и каменного угля.
C2H6 → (t) C + H2 (пиролиз этана)
Химические свойства
- Реакции с неметаллами
- Реакции с металлами
- Восстановительные свойства
- Реакция с водой
- Реакции с кислотами
При нагревании углерод реагирует со многими неметаллами: водородом, кислородом, фтором.
C + H2 → (t) CH4 (метан)
2С + O2 → (t) 2CO (угарный газ — продукт неполного окисления углерода, образуется при недостатке кислорода)
С + O2 → (t) CO2 (углекислый газ — продукт полного окисления углерода, образуется при достаточном количестве кислорода)
С + F2 → (t) CF4
При нагревании углерод реагирует с металлами, проявляя свои окислительные свойства. Напомню, что металлы могут принимать только положительные степени окисления.
Ca + C → CaC2 (карбид кальция, СО углерода = -1)
Al + C → Al4C3 (карбид алюминий, СО углерода -4)
Очевидно, что степень окисления углерода в соединении с различными металлами может отличаться.

Углерод — хороший восстановитель. С помощью него металлургическая промышленность справляется с задачей получения чистых металлов из их оксидов:
Fe2O3 + C → Fe + CO2
ZnO + C → Zn + CO
FeO + C → Fe + CO
Углерод восстанавливает не только металлы из их оксидов, но и неметаллы подобным образом:
SiO2 + C → (t) Si + CO
Может восстановить и собственный оксид:
CO2 + C → CO

Известная реакция взаимодействия угля с водяным паром, называемая также газификацией угля, торфа, сланца — крайне важна в промышленности:
C + H2O → CO↑ + H2↑
В реакциях с кислотами углерод проявляет себя как восстановитель:
C + HNO3(конц.) → (t) CO2 + NO2 + H2O
C + HNO3 → CO2 + NO + H2O
C + H2SO4(конц.) → CO2 + SO2 + H2O

Оксид углерода II — СO
Оксид углерода II — продукт неполного окисления углерода. Несолеобразующий оксид. Это чрезвычайно опасное вещество часто образуется при пожарах в замкнутых помещениях, при прогревании машины в гараже.
Растворяясь в крови угарный газ (имеющий в 300 раз большее сродство к гемоглобину, чем кислород) легко выигрывает конкуренцию у кислорода и занимает его место в эритроцитах. Отравление угарным газом нередко заканчивается летальным исходом.
Получение
В промышленности угарный газ получают восстановлением оксида углерода IV или газификацией угля (t = 1000 °С).
CO2 + C → (t) CO
C + H2O → (t) CO + H2
В лаборатории угарный газ получают при разложении муравьиной кислоты в присутствии серной:
HCOOH → (H2SO4) CO + H2O
Химические свойства
Полностью окисляется до углекислого газа в реакции с кислородом, восстанавливает оксиды металлов.
CO + O2 → CO2
Fe2O3 + CO → Fe + CO2
FeO + CO → Fe + CO2
Образование карбонилов — чрезвычайно токсичных веществ.
Fe + CO → (t) Fe(CO)5

Оксид углерода IV — CO2
Продукт полного окисления углерода. Относится к кислотным оксидам, соответствует угольной кислоте H2CO3. Бесцветный газ, без запаха.
Получение
В промышленности углекислый газ получают при разложении известняка, в ходе производства алкоголя, при спиртовом брожении глюкозы.
CaCO3 → (t) CaO + CO2↑
C6H12O6 → C2H5OH + CO2↑
В лабораторных условиях используют реакцию мела (мрамора) с соляной кислотой.
CaCO3 + HCl → CaCl2 + H2O + CO2↑
Углекислый газ образуется при горении органических веществ:
C3H8 + O2 → CO2 + H2O

Химические свойства
- Реакция с водой
- Реакции с основными оксидами и основаниями
- Окислительные свойства
В результате реакции с водой образуется нестойкая угольная кислота, которая сразу же распадается на воду и углекислый газ.
CO2 + H2O ⇄ H2CO3
В ходе реакций с основаниями и основными оксидами углекислый газ образует соли угольной кислоты: средние — карбонаты (при избытке основания), кислые — гидрокарбонаты (при избытке кислотного оксида).
2KOH + CO2 → K2CO3 + H2O (соотношение основание — кислотный оксид 2:1)
KOH + CO2 → KHCO3 (соотношение основание — кислотный оксид 1:1)
Na2O + CO2 → Na2CO3
При нагревании способен окислять металлы до их оксидов.
Zn + CO2 → (t) ZnO + CO

Угольная кислота
Слабая двухосновная кислота, существующая только в растворах, разлагается на воду и углекислый газ.

Химические свойства
- Качественная реакция
- Средние и кислые соли
- Нагревание солей угольной кислоты
Определить наличие карбонат-иона можно с помощью кислоты: такая реакция сопровождается «закипанием» — появлением пузырьков бесцветного газа без запаха.
MgCO3 + HCl → MgCl2 + CO2↑ + H2O
Я не раз встречал описание реакций, связанных с этой кислотой, которое заслуживает нашего внимания. В задании было сказано, что при добавлении к раствору гидроксида кальция углекислого газа осадок появлялся, при дальнейшем пропускании углекислого газа — помутнение исчезало.
Это можно легко объяснить, вспомнив про способность угольной кислоты образовывать кислые соли, которые растворимы.
Ca(OH)2 + CO2 → CaCO3 (осадок выпадает)
CaCO3 + H2O + CO2 → Ca(HCO3)2 (осадок растворяется)

Чтобы сделать из средней соли (карбоната) — кислую соль (гидрокарбонат) нужно добавить угольную кислоту. Однако написать ее формулу H2CO3 — ошибка. Ее следует записать в виде воды и углекислого газа.
Li2CO3 + CO2 + H2O → LiHCO3 (средняя соль + кислота = кислая соль)
Чтобы вернуть среднюю соль, следует добавить к кислой соли щелочь.
LiHCO3 + LiOH → Li2CO3 + H2O
При нагревании карбонаты распадаются на соответствующий оксид металла и углекислый газ, гидрокарбонаты — на карбонат металла, углекислый газ и воду.
MgCO3 → (t) MgO + CO2
KHCO3 → (t) K2CO3 + CO2↑ + H2O
© Беллевич Юрий Сергеевич 2018-2021
Данная статья написана Беллевичем Юрием Сергеевичем и является его интеллектуальной собственностью. Копирование, распространение (в том числе путем копирования на другие сайты и ресурсы в Интернете) или любое иное использование информации и объектов без предварительного согласия правообладателя преследуется по закону. Для получения материалов статьи и разрешения их использования, обратитесь, пожалуйста, к Беллевичу Юрию
.